南开科研团队在细胞生物合成新型仿生纳米囊泡免疫治疗领域取得重要进展
树突状细胞(DCs)分泌的细胞外囊泡(DEVs)作为DCs疫苗的替代物已进入临床I期和II期试验,显示出良好的可行性和安全性。然而由于复杂的肿瘤免疫微环境,免疫抗原呈递不足以及DEVs在患者体内动态不明等原因,其对肿瘤的免疫疗效有限。以DEVs为基础的免疫治疗与放疗、化疗和光动力治疗等手段相结合产生的协同增效作用将为DEVs的临床治疗提供全新有效的途径,有望解决限制DEVs临床应用的关键问题。近日,澳门永利集团3044王悦冰副教授课题组在利用DEVs免疫治疗肿瘤方面取得新进展。该团队首次以DCs作为生物反应器,高效合成兼具细胞外囊泡和聚集诱导发光(AIE)特性的仿生纳米颗粒(DEV-AIE)。该纳米囊泡既能实时、高效示踪DEVs在小鼠肿瘤模型中的动态变化,同时可进行免疫协同光动力治疗,表现出良好的肿瘤抑制和肿瘤干细胞(CSCs)杀伤能力,解决了DEVs免疫原性低和体外提取产率低等问题,相关研究成果以 “Biosynthetic Dendritic Cell-Exocytosed Aggregation-Induced Emission Nanoparticles for Synergistic Photodynamic Immunotherapy” 为题,发表在国际权威学术期刊《ACS Nano》上(10.1021/acsnano.2c03597)。

EV-AIE纳米囊泡免疫协同光动力治疗肿瘤
在该项工作中,基于该课题组前期细胞外囊泡的研究基础(ACS Nano,2019;ACS Nano,2020;中国发明专利: ZL 201811051433.4),利用DEVs独特的生理特性及其载体优势,该团队提出将DCs作为生物反应器,以能够引起肿瘤细胞线粒体氧化应激的AIE光敏剂作为反应物,在细胞内生物合成并胞吐高产量的新型功能化纳米疫苗DEV-AIE,用于DEVs成像和免疫协同光动力治疗肿瘤。这种仿生合成策略不仅能够保持DEVs膜蛋白的完整性及其免疫原性,而且实现了AIE光敏剂的高效装载。
在生物电镜下,研究人员观察到,AIE光敏剂MBPN-TCyP聚集在DEVs的内部和表面,且胞吐的DEV-AIE具有与DEVs相似的杯状囊泡结构。而且,DEV-AIE具有与AIE光敏剂一致的光学性能。进一步体内外研究发现,胞外分泌的DEV-AIE不仅继承了亲代DCs的免疫调节蛋白,可直接激活T细胞;其高效负载的MBPN-TCyP还可选择性地靶向至肿瘤细胞线粒体,引发其氧化应激反应;显著提高ecto-CRT,ATP以及HMGB1的胞外释放,诱导肿瘤细胞的免疫原性死亡(ICD)。DEV-AIE多途径和多角度的激活了适应性免疫应答,进而有效抑制了原发肿瘤、远端肿瘤和转移瘤。同时,课题组还发现,DEV-AIE能够显著杀伤4T1和CT26实体瘤中的CSCs。本研究为细胞外囊泡仿生纳米药物的开发提供了一种无创、高效、简便的策略,并证明了基于DEVs的免疫治疗和AIE光敏剂介导的光动力治疗是临床抗肿瘤纳米疫苗的一个强有力方向,为临床的肿瘤免疫治疗提供了新手段和思路。
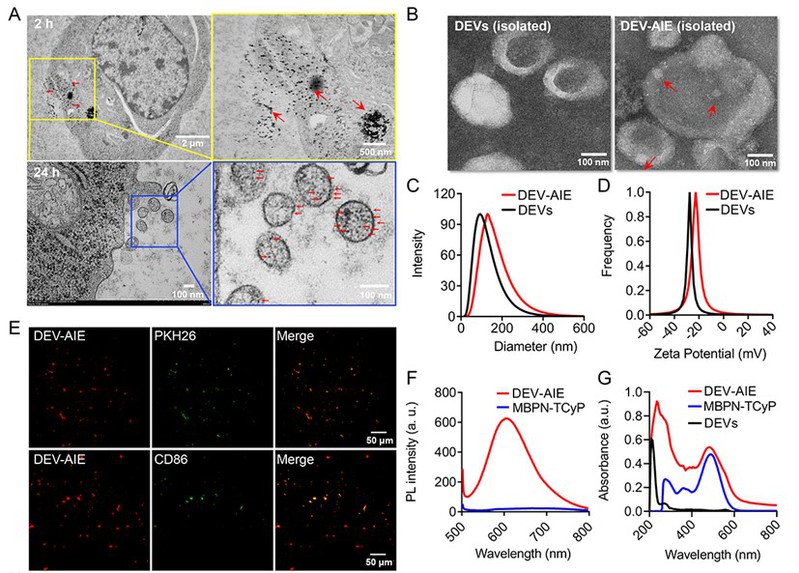
DEV-AIE纳米囊泡的生物合成及鉴定
据悉,该研究得到了国家重点研发计划和国家自然科学基金的资助。澳门永利集团3044为第一完成单位,澳门永利集团3044王悦冰副教授为本文的通讯作者,澳门永利集团3044硕士生曹红梅和生命科学学院博士生高贺麒为本文并列第一作者。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.2c03597





